Pengertian Stoikiometri Larutan – Hukum – Jenisnya
Kimia adalah salah satu cabang ilmu pengetahuan yang dihasilkan dari perdebatan yang panjang dan dalam sejarahnya para ahli memperdebatkan mengenai etimologi kimia. Secara etimologi kata kimia berasal dari kata alkimia yang artinya serangkaian praktik yang dilakukan pada masa lampau dan alkimiawan terkemuka terus mengemukakan pendapatnya tentang kimia, hal ini mendorong kimia pada era yang modern. Robet Boyle adalah salah seorang alkimiawan yang pertama kali menerapkan metode ilmiah dalam membedakan kimia dengan alkimia dan Boyle dianggap sebagai bapak pendiri kimia, karena hasil karyanya sangatlah penting bagi kehidupan manusia di masa modern.
Kimia menjadi salah satu ilmu yang memiliki beberapa cabang seperti kimia analitik, biokimia, kimia anorganik, kimia organik dan kimia fisik.
- Kimia analitik adalah cabang ilmu kimia yang memberikan analisis komponen kimia dalam bentuk sampel dan analisis kualitatif menjadi metode yang digunakan.
- Biokimia adalah salah satu ilmu yang mengkaji tentang senyawa kimia, reaksi kimia dan interaksi kimia.
- Kimia anorganik adalah cabang ilmu kimia yang mengkaji tentang sifat dan reaksi dari senyawa anorganik.
- Kimia Organik adalah cabang ilmu kimia yang mengkaji tentang senyawa karbon.
- Kimia Karbon adalah cabang ilmu kimia yang membahas mengenai sifat fisik suatu molekul dan hubungan dalam menyatukan molekul serta atom.
Dalam ilmu kimia, stoikiometri larutan menjadi salah satu titik pembahasan yang sangat penting.
Pengertian Stoikiometri Larutan
Stoikiometri adalah dasar dalam melakukan perhitungan kimia yang menyatakan suatu relasi kuantitatif rumus kimia dengan persamaan kimia dan ada berbagai materi yang harus dikuasai dalam konsep Stoikiometri seperti konsep molaritas dengan massa molaritas, konsep rumus empiris dengan rumus molekular, konsep dasar Stoikiometri larutan dengan gas ideal dan penulisan reaksi dengan penyetaraan reaksi.
Stoikiometri didasarkan pada hukum dasar kimia seperti hukum kekekalan massa, hukum perbandingan yang tetap dan hukum perbandingan berganda. Stoikiometri Larutan didasarkan pada konsentrasi larutan yang dilakukan untuk menyatakan jumlah zat yang dilarutkan ke pelarut dan konsentrasi larutan dinyatakan dalam molaritas.
Hukum Stoikiometri Larutan
1. Kekekalan Massa
Hukum kekekalan massa menyebutkan bahwa massa reaktan memiliki nilai yang sama dengan massa produk dan stoikiometri bermanfaat untuk mengumpulkan data-data mengenai unsur yang berperan dalam proses reaksi kimia. Hukum kekekalan massa juga terkenal dengan sebutan hukum Lomonosov Lovoisier dan Hukum kekekalan massa juga menjelaskan bahwa suatu massa dapat berubah bentuk, namun tidak dapat dimusnahkan serta diciptakan. Hukum kekekalan massa digunakan dalam berbagai bidang ilmu yang sangat penting seperti kimia, teknik kimia dan mekanika. Setiap reaksi kimia, pasti mengalami perubahan wujud zat yang bervariasi.
2. Perbandingan Tetap
Hukum perbandingan tetap adalah hukum yang menyatakan bahwa suatu senyawa kimia selalu berisikan proporsi yang sama dengan massa dan hukum ini memiliki penjabaran yang sangat jelas. Hukum perbandingan tetap juga terkenal dengan sebutan hukum Proust, karena diambil dari nama ilmuwan terkemuka asal Perancis. Hukum ini juga menyebutkan setiap sampel senyawa pasti memiliki komposisi unsur yang tetap atau sama dan Hukum perbandingan tetapjuga menjadi salah satu dasar hukum Stoikiometri. Ada banyak pengaruh suhu terhadap benda dan setiap benda pasti menghasilkan gerakan yang bervariasi.
3. Perbandingan Berganda
Hukum perbandingan berganda adalah hukum dasar yang membahas mengenai stoikiometri dan dalam hukum ini disebutkan bahwa dua unsur yang membentuk 1 senyawa, akan menghasilkan rasio massa yang bervariasi. Hukum perbandingan berganda menjadi pengembangan dari hukum perbandingan tetap dan banyak yang menyebut hukum ini sebagai hukum Dalton. John Dalton pertama kali menemukan hukum perbandingan berganda pada tahun 1803 dan hukum ini masih dipakai sampai dengan sekarang. Hukum perbandingan berganda merumuskan penemuannya berdasarkan hasil pengamatan terhadap hasil temuan dari Proust.
Jenis Stoikiometri Larutan
1. Stoikiometri Reaksi
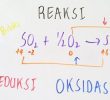
Stoikiometri Reaksi sangat berguna untuk menyeimbangan suatu persamaan kimia dan Stoikiometri Reaksi memiliki peranan penting dalam melakukan reaksi kimia. Setiap reaksi kimia yang terjadi, pasti memiliki suhu yang bervariasi dan reaksi kimia pasti berjalan dengan bervariasi. Hubungan kuantitatif yang terjadi antar zat memiliki peranan dalam melakukan reaksi kimia dan hal ini sangat penting untuk dipelajari lebih mendalam, karena menjadi pengetahuan dasar yang sangat penting di bidang kimia.
2. Stoikiometri Komposisi
Stoikiometri Komposisi adalah berguna untuk menjelaskan massa hubungan antara unsur-unsur dengan senyawa dan gabungan dari berbagai unsur sangat terlihat dalam Stoikiometri Komposisi. Kejelasan mengenai hubungan antara nitrogen dengan hidrogen menghasilkan amonia yang sangat kompleks dan Stoikiometri Komposisi memiliki peranan yang sangat penting dalam reaksi kimia. Molaritas digunakan dalam kimia untuk menyatakan jumlah zat. Setiap reaksi kimia pasti memiliki wujud zat yang bervariasi dan setiap reaksi kimia pasti memiliki hasil yang bervariasi.
3. Stoikiometri Gas
Stoikiometri Gas adalah reaksi yang melibatkan gas dan pada saat proses reaksi terjadi pasti melibatkan gas dalam suhu, volume dan tekanan yang sering disebut dengan gas ideal. Dalam sebuah gas, perbandingan antara volume dengan hukum gasnya bernilai sama dan gas ideal adalah gas teoritis yang terdiri dari partikel yang gerak secara acak. Stoikiometri Gas menjadi salah satu jenis Stoikiometri larutan yang sangat bermanfaat dan memiliki peranan penting dalam proses kimia.
Demikian ulasan lengkap mengenai Stoikiometri Larutan dan semoga artikel ini dapat bermanfaat bagi para pembacanya.