Perbedaan Oksidasi dan Reduksi serta Contohnya
Oksidasi serta reduksi merupakan dua jenis reaksi kimia yang biasanya saling bekerja sama. Oksidasi serta reduksi merupakan reaksi menggunakan pertukaran elektron antara reaktan.
Untuk anda yang masih bingung, berikut kami berikan ulasan tentang perbedaan oksidasi dan reduksi dari berbagai segi dari mulai pengertian, jenis, reaksi, contoh dan masih banyak lagi yang lainnya.
Perbedaan Dari Segi Pengertian

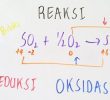
Perbedaan pertama dari oksidasi dan reduksi adalah dari segi pengertiannya. Redoks merupakan singkatan dari reduksi oksidasi yakni yang terjadi dalam reaksi kimia. Sementara oksidasi mengacu pada hilangnya elektron.
Reduksi merupakan peristiwa bertambahnya kembali elektron yang dalam bahasa sederhana berarti perubahan bilangan oksidasi atom baik oksidasi dan juga reduksi. Reaksi tersebut bisa sangat sederhana atau kompleks bergantung dari proses serta atom yang terlibat.
Oksidasi bisa diartikan peningkatan bilangan oksidasi, sementara reduksi merupakan kondisi penurunan bilangan oksidasi. Meski penambahan atau penurunan elektron adalah prasyarat reaksi redoks, namun ada reaksi di mana tidak terjadi transfer elektron yang dinamakan dengan reaksi metatesis.
Perbedaan Dari Penggabungan dan Pelepasan Oksigen

Reaksi oksidasi merupakan bergabungnya oksigen dari sebuah zat. Sebagai contoh dari reaksi oksidasi adalah pada perkaratan besi yakni bergabungnya oksigen serta besi 4Fe [s] + 302 [g] → 2Fe2O3.
Pada reaksi tersebut, besi [Fe] akan mengikat oksigen yang mengartikan besi dioksidasi. Zat yang akan mengalami oksidasi atau zat yang mereduksi zat lain dinamakan dengan reduktor. Contoh dari reaksi oksidasi lainnya adalah C (s) + O2 (g) → CO2 (g).
Sedangkan reaksi reduksi merupakan peristiwa pelepasan atau pengurangan dari oksigen pada sebah zat. Contohnya adalah reaksi gas SO3 dengan reaksi 2 SO3 (g) → 2SO2 (g) + O2 (g). Dalam reaksi tersebut, SO3 akan mengalami pengurangan jumlah oksigen yang berhubungan. Sedangkan zat yang mengalami reduksi atau zat yang mengoksida zat lain dinamakan dengan oksidator.
Perbedaan Dari Pelepasan dan Penerimaan Elektron

Perbedaan oksidasi dan reduksi berikutnya adalah dari pelepasan dan penerimaan elektron. Reaksi oksidasi merupakan peristiwa pelepasan elektron. Contohnya adalah Fe menjadi Fe3+ dengan reaksi Fe → Fe3+ + 3e– dimana Fe akan melepaskan elektron menjadi ion Fe3+ dan reduktor merupakan pelepasan elektron.
Sedangkan reaksi reduksi merupakan peristiwa penerima elektron seperti contohnya Cl2 menjadi Cl- dan oksidator merupakan pengikat elektron.
Perbedaan dari Peningkatan dan Penurunan Bilangan Oksidasi (Biloks)

Reaksi oksidasi merupakan peristiwa naiknya bilangan oksidasi sebuah unsur. Contohnya adalah Fe → Fe3+ + 3e– : biloks Fe berubah dari 0 menjadi 3 [Kenaikan biloks].
Sedangkan reaksi reduksi merupakan peristiwa menurunnya bilangan oksidasi sebuah unsur. Contohnya adalah Cl2 + 2e– → 2Cl– : biloks Cl berubah dari 0 menjadi -1 [Penurunan biloks].
Perbedaan Dari Segi Reaksi

Ada beberapa jenis perbedaan dari segi reaksi antara oksidasi dan reduksi. Untuk redoks meliputi beberapa reaksi yakni kombinasi, pertukaran, dekomposisi seta disproporsionasi.
1. Reaksi Kombinasi
Reaksi kombinasi merupakan reaksi pada saat ada dua atau lebih unsur yang bergabung membentuk senyawa tunggal.
2. Reaksi Dekomposisi
Reaksi dekomposisi atau pengurangan merupakan reaksi pada saat sebuah senyawa memecah atau terurai menjadi dua atau lebih unsur atau zat sederhana. Reaksi dekomposisi umumnya disebut dengan kebalikan dari reaksi kombinasi.
Berikut adalah contoh reaksinya:
+2+4-2 +2-2 +4-2
CaCo3 -> Ca O + C O2
Karena tidak ada perubahan pada bilangan oksidasi pada setiap unsur, maka reaksi tidak termasuk dalam reaksi redoks. Supaya reaksi dekomposisi bisa menjadi reaksi redoks, maka setidaknya harus ada satu komponen yang terbentuk dalam bentuk unsur.
3. Reaksi Pertukaran
Reaksi pertukaran atau biasa disebut dengan pergantian merupakan reaksi ketika atom atau ion di dalam sebuah senyawa digantikan atom atau ion dari senyawa lainnya. Reaksi penggantian bisa dikelompokkan menjadi penggantian logam atau non logam.
Penggantian logam tersebut terjadi pada saat sebuah logam dalam sebuah senyawa terganti dengan logam yang lebih reaktif dalam kondisi bebas. Berikut adalah contohnya:
+3 -2 0 0 +3 -2
Fe2 O3 + 2Al -> 2Fe + Al2 O3
+2 +6 -2 0 0 +2 +6 -2
Ni S O4 + Co -> Ni + Co S O4
Reaksi penggantian logam bermanfaat dalam proses metalurgi pada saat logam murni didapat dari senyawa yang ada dalam bijih. Sedangkan reaksi penggantian nonlogam termasuk penggantian halogen, hidrogen dan terkadang juga oksigen. Seluruh logam alkali serta beberapa logam alkali tanah [Ca, Sr dan juga Ba] menggantikan hidrogen dari air dingin. Berikut adalah contoh reaksinya:
0 +1 -0 +1-2+1 0
2Na + 2H2O -> 2Na O H+H2
4. Reaksi Disproporsionasi
Jenis reaksi redoks yang terakhir adalah disproporsionasi yang terjadi pada saat unsur yang sama dalam waktu bersamaan teroksidasi serta tereduksi. Unsur yang mempunyai tiga atau lebih bilangan oksidasi bisa bertindak sebagai oksidator serta reduktor sendiri.
Sedangkan untuk jenis reaksi oksidasi tidak terjadi sebanyak jenis reaksi.
Reaksi elektrokimia terjadi pada saat kawat tembaga ditempatkan dalam larutan mengandung ion perak dan elektron akan ditransfer dari logam tembaga ke ion perak. Logam tembaga nantinya akan teroksidasi dan kumis logam perak tumbuh ke kawat tembaga, sedangkan ion tembaga akan dilepaskan dalam larutan.
Contoh Oksidasi dan Reduksi

Berikut akan kami berikan beberapa contoh reaksi oksidasi dan juga reduksi di dalam kehidupan sehari hari.
Contoh Reaksi Oksidasi
1. Zat Pemutih
Contoh reaksi oksidasi pertama terjadi pada zat pemutih. Zat pemutih merupakan senyawa yang bisa dipakai untuk menghilangkan warna benda seperti rambut, tekstil dan juga kertas. Proses penghilangan warna tersebut terjadi lewat reaksi oksidasi. Sedangkan oksidator yang biasa dipakai adalah natrium hipoklorit [NaOCl] serta hidrogen peroksida [H202].
Warna benda akan dihasilkan elektron yang diaktivasi oleh sinar tampak dan hilangnya warna disebabkan karena oksidator bisa menghilangkan elektron tersebut dan elektron yang dilepaskan lalu diikat oksidator.
2. Fotosintesis
Fotosintesis merupakan proses reaksi oksidasi yang terjadi secara alami. Fotosintesis adalah proses kompleks yang melibatkan alga hijau, tumbuhan hijau atau bakteri tertentu. Organisme tersebut hanya bisa memakai sinar matahari atau cahaya ultraviolet yang kemudian akan menghasilkan gula serta oksigen.
Contoh Reaksi Reduksi
1. Pernapasan
Contoh reaksi reduksi yang pertama adalah pernapasan. Pernapasan seluler memungkinkan organisme membebaskan energi yang tersimpan di dalam ikatan kimia glukosa. ATP adenosin trifosfat yakni senyawa penyuplai energi sederhana akan mendorong berbagai proses metabolisme lain dimana glukosa akan teroksidasi serta oksigen yang akan tereduksi.
2. Pembakaran
Proses pembakaran seperti salah satunya senyawa hidrokarbon pada bahan bakar fosil dan juga pembakaran bahan organik di kayu menjadi salah satu contoh reaksi reduksi. Karbon yang ada di senyawa akan dibakar atom oksigen pada udara, sedangkan beberapa ikatan oksigen ke hidrogen di dalam senyawa. Untuk itu, senyawa yang dibakar akan dioksidasi, sedangkan oksigen akan direduksi.