Hidrolisis: Jenis – Rumus dan Contohnya
Hidrolisis merupakan proses penguraian zat kimia dari air dan tergantung dari kelarutan, kimia, pH dalam air serta potensi senyawa yang teroksidasi reduksi atau redoks. Hidrolisis merupakan proses penguraian kimia memakai air yang bertujuan untuk memisahkan ikatan zat kimia yang terdiri dari dua jenis yakni hidrolisis asam serta enzimatik.
Di dalam kimia, hidrolisis asam merupakan proses asam protik dipakai untuk mengkatalisasi pembelahan ikatan kimia lewat reaksi substitusi nukleofil dengan penambahan unsur air.
Sedangkan hirdolisis enzimatik merupakan proses mengubah selulosa menjadi gula pereduksi dari aksi selulase sehingga bisa difermentasi oleh ragi atau bakteri menjadi etanol. Supaya bisa lebih jelas, silahkan simak ulasan kami tentang pengertian hidrolisis lengkap dengan jenis, macam, rumus dan lainnya.
Pengertian Hidrolisis

Hidrolisis merupakan reaksi kimia di mana H2O yakni molekul dari air yang terurai atau terpecah dalam bentuk kation H+ atau hidrogen serta anion 0H- atau hidroksida lewat proses kimiawi.
Proses hidrolisis ini berguna untuk memecah polimer tertentu terutama polimer yang terbuat dari proses bertahap polimerisasi atau disebut dengan istilah step growth polimerization. Istilah hidrolisis sendiri diambil dari bahasa Yunani yakni hydro yang berarti air dan juga lysis yang berarti pemisahan.
Hidrolisis sendiri berbeda dengan hidrasi. Untuk hidrasi, molekul tidak akan terpecah menjadi 2 senyawa baru. Sedangkan hidrolisis adalah reaksi penguraian garam oleh air atau reaksi ion garam dengan air.
Jenis Hidrolisis

Untuk jenis hidrolisis terdiri dari dua jenis yakni hidrolisis parsial atau sebagian dan juga hidrolisis total.
- Hidrolisis Parsial atau Sebagian
Hidrolisis parsial atau sebagian bisa terjadi ketika garam dari asam lemah dan basa kuat atau sebaliknya. Pada hidrolisis sebagian ini, hanya salah satu ion yang akan mengalami reaksi hidrolisis dan yang lainnya tidak.
Contohnya adalah garam NH4Cl, ketika di dalam air NH4Cl akan terionisasi sempurna membentuk ion Cl dan juga NH4+.
- Hidrolisis Total
Hidrolisis total bisa terjadi ketika garam dari asam lemah dan dari basa lemah. Contohnya adalah HF [aq] +.
NH4OH(aq) ^ NH4F (aq) + H2O(l)
Garam atau natrium yang terbentuk akan mengalami ionisasi sempurna di dalam air.
NH4F (aq) ^ NH4+(aq) + F (aq)
Baik itu kation atau anion sama sama akan mengalami hidrolisis karena keduanya berasal dari spesi yang lemah dan reaksi yang terjadi adalah sebagai berikut:
NH4+(aq) + H2O(l) <—- > NH4OH(aq) + H+(aq)
F”(aq) + H2O(l) <—- > HF(aq) + OH”(aq)
Rumus Hidrolisis

Berikut adalah beberapa rumus hidrolisis dari komponen asam lemah dan basa kuat, komponen asam kuat dan basa lemah serta komponen asam lemah dan basa lemah.
1. Rumus Hidrolisis dari Komponen Asam Kuat dan Basa Lemah
Garam dari asam kuat dan basa lemah di dalam air nantinya akan mengalami hidrolisis sebagian akibat salah satu komponen garam atau kation basa lemah mengalami hidrolisis menghasilkan ion H+, sehingga pH < 7 dan larutan garam bersifat asam.
Rumus:

Keterangan:
- Kh: Konstanta hidrolisis.
- Kw: Konstanta air.
- Kb: Konstanta basa.
- [H]: Konsentrasi garam.
- h: Derajat hidrolisis.
Sedangkan untuk menentukan besar derajat hidrolisis garam dari asam kuat dan basa lemah, maka dipakai rumus seperti gambar di bawah ini:
2. Rumus Hidrolisis dari Komponen Asam Lemah dan Basa Kuat
Garam dari asam lemah dan basa kuat di dalam air nantinya akan mengalami hidrolisis sebagian. Komponen garam atau anion asam lemah akan mengalami hidrolisis kemudian menghasilkan ion OH- sehingga pH >7 dan larutan garam memiliki sifat basa.
Contohnya adalah CH3COOL, CH3COONa, KCN, CaS dan lain sebagainya.
- Reaksi ionisasi: CH3COOK( aq ) → K+( aq ) + CH3COO-( aq ).
- Reaksi hidrolisis: K + (aq) + H2O(l) -/-> (tidak terhidrolisis) CH3COO-( aq ) + H2O( l ) → CH3COOH( aq ) + OH-( aq ) bersifat basa.
Untuk rumus selengkapnya bisa dilihat pada gambar berikut ini:

3. Rumus Hidrolisis dari Komponen Asam Lemah dan Basa Lemah
Garam dari asam lemah serta basa lemah dalam air akan mengalami hidrolisis total sebab kedua komponen garam atau anion asam lemah dan kation basa lemah terhidrolisis akan menghasilkan ion H+ serta ion OH- sehingga harga pH larutan tersebut akan tergantung dari harga Ka serta Kb.
Untuk rumus selengkapnya bisa dilihat pada gambar di bawah ini:

Keterangan:
- Kw: Konstanta air.
- Ka: Konstanta asam.
- Kb: Konstanta basa.
- Kh: Konstanta hidrolisis.
Harga dari pH garam yang terbentuk dari komponen asam lemah serta basa lemah akan tergantung dari harga Ka serta Kb:
- Jika Ka = Kb, maka larutan bersifat netral (pH = 7).
- Jika Ka > Kb, maka larutan bersifat asam (pH < 7).
- Jika Ka < Kb, maka larutan bersifat basa (pH > 7).
Contoh Soal Hidrolisis
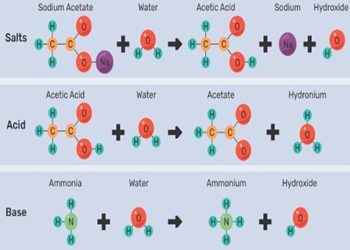
Berikut ini akan kami jelaskan beberapa contoh soal dari reaksi hidrolisis berdasarkan jenisnya yakni anion, kation dan juga kation serta anion terhidrolisis:
1. Contoh Hidrolisis Anion
CH3COONa(aq) → CH3COO–(aq) + Na+ (aq)
CH3COO– + H2O ↔ CH3COOH + OH–
Na+ + H2O → tidak terjadi reaksi
Dari contoh ini diterangkan jika CH3COO akan bertindak sebagai anion asam lemah terhidrolisis yang kemudian membentuk OH- pada saat direaksikan dengan molekul air atau H20. Sementara Na+ bertindak sebagai kation dari basa kuat yang tidak terhidrolisis pada saat direaksikan dengan molekul air.
Kesimpulannya adalah garam dengan komponen pembentuk asam lemah dan juga basa kuat, jika direaksikan dengan air maka akan terhidrolisis sebagian dan kemudian menghasilkan ion yang bersifat basa.
2. Contoh Hidrolisis Kation
NH4Cl → NH4+ + Cl–
NH4+ + H2O ↔ NH4OH + H+
Cl– + H2O → ada reaksi
Dari contoh di atas, NH4+ yang bertindak sebagai basa lemah akan terhidrolisis dan kemudian menghasilkan ion yang memiliki sifat asam yaitu H+. Sementara Cl- yang sebagai anion asam kuat tidak akan terhidrolisis.
3. Contoh Kation dan Anion Terhidrolisis
CH3COONH4 → CH3COO– + NH4+
CH3COO– + H2O ↔ CH3COOH + OH–
NH4+ + H2O ↔ NH4OH + H+
Dari contoh di atas, kedua komponen penyusun garam CH3COO– yakni anion dari asam lemah dan juga NH4+ yakni kation dari basa lemah dapat terhidrolisis yang sempurna dan masing masing berurutan serta menghasilkan ion yang bersifat basa [OH-] serta ion bersifat asam [H+].