Pengertian Reaksi Redoks – Fungsi – Penyetaraan dan Soal
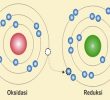
Redoks merupakan sebuah istilah untuk menjelaskan perubahan bilangan oksidasi atau kondisi oksidasi atom atom di dalam reaksi kimia. Hal ini bisa berbentuk proses redoks sederhana seperti oksidasi karbon yang kemudian menghasilkan karbondioksida atau reduksi karbon dari hidrogen yang menghasilkan metana CH4.
Atau bisa berupa proses kompleks seperti oksidasi gula di tubuh kita lewat rangkaian transfer elektron yang rumit. Berikut akan kami jelaskan tentang reaksi redoks selengkapnya.
Pengertian Reaksi Redoks
Reaksi redoks merupakan reaksi kimia yang mengakibatkan terjadinya perubahan bilangan oksidasi di sebuah unsur atau molekul yang terjadi karena faktor yang mempengaruhi laju reaksi.
Tidak hanya ditandai dengan perubahan bilangan oksidasi, namun reaksi redoks juga ditandai dengan penambahan atau pengurangan oksigen di sebuah molekul. Reaksi redoks terjadi karena adanya reaksi reduksi dan juga oksidasi.
Istilah redoks sendiri diambil dari dua konsep yakni reduksi dan juga oksidasi.
- Oksidasi: Pelepasan elektron dari sebuah molekul, ion atau atom.
- Reduksi: Penambahan elektron dari suatu atom, molekul atau ion.
Meski tepat digunakan untuk banyak fungsi, namun oksidasi dan reduksi lebih tepatnya merujuk pada berubahnya bilangan oksidasi akibat transfer elektron yang sebetulnya tidak selalu akan terjadi. Untuk itu, oksidasi lebih tepat didefinisikan menjadi peningkatan bilangan oksidasi serta reduksi sebagai penurunan bilangan oksidasi.
Pada praktiknya, transfer elektron selalu mengubah bilangan oksidasi akan tetapi ada banyak reaksi yang diklasifikasikan sebagai redoks meski tidak terjadi transfer elektron pada reaksi tersebut seperti contohnya ikatan kovalen.
Oksidator dan Reduktor
Beberapa bahan kimia oksidator mempunyai kemampuan mengoksidasi senyawa lainnya yang disebut sebagai oksidatif dan dikenal juga dengan oksidator atau agen pengoksidasi. Oksidator nantinya akan melepaskan elektron dari senyawa lainya sehingga akan tereduksi dengan sendirinya.
Untuk itu, ini akan menerima elektron yang disebut juga sebagai penerima elektron. Oksidator umumnya merupakan beberapa senyawa yang memiliki unsur dengan bilangan oksidasi yang tinggi atau senyawa yang bisa sangat elektronegatif sehingga bisa memperoleh satu atau dua elektron yang lebih dengan cara mengoksidasi suatu senyawa seperti fluorin, oksigen dimana ada banyak manfaat oksigen bagi tubuh, bromin dan juga klorin atau klor.
Beberapa senyawa tersebut mampu mereduksi senyawa lainnya yang dikatakan reduktif dan disebut dengan reduktor atau agen pereduksi. Reduktor nantinya akan melepaskan elektron ke senyawa lainnya sehingga bisa teroksidasi dengan sendirinya. Untuk itu, ia akan memberikan elektronnya sehingga dinamakan juga dengan penderma elektron dan senyawa tersebut bisa berupa reduktor yang sangat bervariasi.
Beberapa unsur logam seperti Zn, Na, Li, Al, Fe dan Mg bisa dipakai sebagai reduktor. Beberapa logam tersebut bisa memberikan elektron dengan sangat mudah. Sedangkan untuk reduktor lainnya yakni reagen transfer hidrida seperti contohnya NaBH dan juga LiAIH4. Reagen reagen tersebut dipakai secara luas di kimia organik khususnya pada reduksi beberapa senyawa karbonil menjadi alkohol.
Fungsi Reaksi Redoks
Fungsi dari reaksi redoks yang terdapat dalam kehidupan kita sehari hari, sebenarnya cukup banyak dan berikut adalah beberapa fungsi dari reaksi redoks dalam kehidupan sehari hari:
- Reaksi di proses fotosintesis pada tumbuhan.
- Pemakaian lumpur aktif ke dalam pengolahan limbah.
- Oksidasi makanan di sel.
- Mur dan juga baur diberikan lapisan zinc dan di lapisan itu ada proses oksidasi logam zinc serta reduksi pada bagian kation.
- Peralatan dapur denga material stainless steel tidak akan berkarat sebab di permukaannya sudah terlapisi oksida dengan proses oksidasi yang berkelanjutan.
- Pemahaman fenomena korosi logam serta cara mencegahnya.
- Pembuatan asam sulfat di kebutuhan sebuah industri.
- Mengolah bijih logam di industri pertambangan.
- Metabolisme di beberapa jaringan penyusun tubuh manusia serta organ tubuh memakai reaksi redoks.
Penyetaraan Reaksi Redoks
Penyetaraan reaksi redoks bisa dilakukan dengan dua cara yakni cara setengah reaksi dan juga cara perubahan bilangan oksidasi.
- Cara Setengah Reaksi
Langkah pertama penyetaraan reaksi redoks dilakukan dengan cara setengah reaksi. Tahap pertama dilakukan dengan emmisahkan reaksi menjadi 2 ruas bentuk reaksi yakni ruas pertama dan juga ruas kedua. Setiap persamaan adalah persamaan reaksi reduksi dan juga reaksi oksidasi.
Cr2072 -> 2Cr3+
Cu+ -> Cu2+
Tahap kedua adalah menyetarakan jumlah unsur yang ada di dalam reaksi redoks. Dalam persamaan ini, ada penyetaraan dengan penulisan dua di jumlah Cr pada bagian hasil atau produk.
Cr2O72- -> 2 Cr3+
Cu+ -> Cu2+
Untuk tahapan 3 adalah penambahan unsur untuk molekul yang belum ditulis pada reaksi. Dalam tahap ini, ada penambahan unsur-unsur air [H2O]. Apabila reaksi terjadi di kondisi asam, penambahan air di bagian yang kekurangan atom O akan tetapi jika reaksi terjadi di kondisi basa penambahan aor di atom yang kelebihan atom O.
Dalam reaksi tersebut, ada penambahan di bagian hasil atau produk. Sesudah itu akan dilakukan penyetaraan jumlah koefisien molekul yang menyatakan jika jumlah setiap unsur pada molekul.
Cr2O72- -> 2 Cr3+ + 7 H2O
Cu+ -> Cu2+
Untuk tahap keempat adalah menyetarakan atom hidrogen dengan ion [H+] apabila suasana asam atau dengan ion [OH-] apabila kondisi basa. Karena reaksi ada di kondisi asam, maka di bagian reaksi ditambahkan ion [H+].
14 H+ + Cr2O72– -> 2 Cr3+ + 7 H20
Cu+ -> Cu2+
Untuk tahap kelima, sesudah penyetaraan jumlah unsur di bagian reaksidan bagian produk, maka langkah berikutnya adalah penyetaraan bilangan oksidasi yang ada di kedua ruas baik itu kanan dan kiri. Penyetaraan tersebut dilakukan dengan menambahkan elektron di sebelah kanan atau kiri persamaan reaksi.
6e + 14 H+ + Cr2O72- -> 2 Cr3+
Cu+ -> Cu2+ + e
Untuk tahap keenam yakni tahap akhir dari penyetaraan reaksi adalah menggabungkan dua reaksi yang sebelumnya dipisah dan juga menyetarakan jumlah elektron selain ruas kanan atau kiri kedua reaksi tersebut.
Dalam penggabungan reaksi ini, pada bagian reaksi ruas kedua akan dikalikan dengan 6 sebanding dengan jumlah elektron yang terdapat di bagian reaksi ruas pertama. Dengan begitu, penggabungan kedua reaksi tersebut akan saling menghilangkan ion elektron sebanyak 6e.
6e + 14H+ + Cr2O72- -> 2 Cr3+
6 Cu+ -> 6 Cu2+ + 6e
Contoh Soal Reaksi Redoks
Agar lebih jelas, berikut akan kami berikan contoh soal reaksi redoks yang bisa anda pelajari:
Tentukan reaksi berikut ini:
2CuSO4+4KI->2Cul+I2+2K2S04
Pertanyaannya adalah, apakah reaksi diatas merupakan reaksi redoks atau bukan? dan jika benar, maka tentukan reduktor, oksidator, hasil oksidasi dan juga hasil reduksinya.
Pembahasan:
Karena mempunyai senyawa bebas [I2], maka reaksi ini termasuk ke dalam reaksi redoks. Bisa dilihat jika atom Cu di CuSO4 mengalami sebuah reduksi sebab terjadi penurunan biloks, kemudian di atom I pada KI mengalami oksidasi sebab terjadinya peningkatan biloks.
Demikian ulasan dari kami tentang reaksi redoks dari mulai pengertian, fungsi, penyetaraan hingga contoh soalnya. Semoga bisa menambah informasi anda seputar kimia.