Persamaan Gas Ideal dan Contoh Soalnya
Partikel gas bergerak sangat bebas sehingga kesulitan untuk mempelajari sifat gas tersebut. Penyederhanaan permasalahan untuk mempelajari gas adalah dengan membuat batasan pengertian dan ruang lingkup tentang gas ideal tersebut. Gas ideal merupakan gas yang memiliki sifat-sifat khusus yang ideal. Diantaranya memiliki sifat tumbukan lenting sempurna, berlaku hukum gerak Newton, tidak ada gaya antar partikel, bergerak ke segala arah dan tersebar merata. Dalam kehidupan yang sebenarnya gas ideal tidak pernah ada.
Sifat-sifat Gas Ideal
- Terdiri dari molekul (partikel) dalam jumlah besar berupa atom atau kelompok atom
- Partikel gas selalu bergerak secara acak dengan arah sembarang, namun semuamolekul tersebutbergerak ke segala arah dengan berbagai kelajuan.
- Partikel gas dalam ruangan atau wadah terdistribusi merata kesegala penjuru ruangan atau wadahnya.
- Partikel gas memenuhi Hukum Newton tentang Gerak (baca: Contoh hukum newton 3 dan penjelasannya )
- Tumbukan antar molekul atau bilik yang terbentur dengan gas merupakan tumbukan lenting sempurna yang terjadi dalam waktu singkat.
Persamaan Gas Ideal
Kompenen besaran yang terlibat dalam membentuk persamaan yang berkaitan dengan beberapa hukum tentang gas ideal oleh beberapa ilmuan:
- Tekanan (P)
- Volume (V)
- Temperatur mutlak (T)
Ilmuan yang mempelajari mengenai gas ideal dan mengahsilkan beberap hukum dan persamaan yang menjadi dasar gas ideal yaitu yaitu Robert Boyle dengan Hukum Boyle, Jacques Chares dengan Hukum Charles, Joseph Gay Lussac dengan Hukum Gay Lussac. Dari ketiga ilmuan tersebut tercetus masing-masing hukum dan terlahir persamaan gabungan dari ketiganya yang dikenal dengan Hukum Boyle-Gay Lussac sehingga didapat persamaaan umum yang sering dipakai saat ini. Berikut penjelasan masing-masing hukum yang mereka pelajari mengenai gas ideal.
baca juga:
-
Hukum Boyle
Hukum ditemukan oleh seorang ilmuan Robert Boyle (1627-1691) dikenal dengan Hukum Boyle. Hukum Boyle mengungkapkan bahwa:
“Hasil dari perkalian antara tekanan dan volume jika temperaturnya tetap adalah konstan.”
Hukum tersebut dapat ditulis dengan persamaan sebagai berikut:
P V = konstan atau P1 V1 = P2 V2
Keterangan :
P1 = tekanan gas awal (N/m2)
V1 = volume gas awal (m3)
P2 = tekanan gas akhir (N/m2)
V2 = volume akhir (m3)
Hubungan tekanan dan volume pada temperatur tetap pada hukum Boyle dapat digambarkan dalam bentuk grafik berikut.
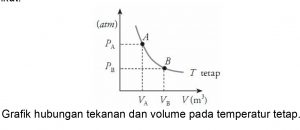
Contoh Soal:
Suhu gas pada ruang tertutup pada adalah 27 oC memiliki tekanan sebesar 5 x 105 Pa. Volume mula mula adalah V yang kemudian ditekanan hingga volume menjadi ¼ V. Berapakan tekanan terakhir?
Penyelesaian :
Diketahui :
T1 = (27 + 273) K = 300 K
V1 = V
V2= ¼ V
P1= 1,5 x 105 Pa
Ditanyakan: P2 ………….?
Jawab:
P1. V1 = P2 . V2
(1,5 x 105) . V = P2 . (¼ V )
P2= 5 x 105 Pa
Jadi tekanan terakhir adalah 5 x 105 Pa
-
Hukum Charles
Penyelidikan dilanjutkan oleh Jacques Charles (1747-1823). Dari hasil penyelidikannya itu kemudian dikenal Hukum Charles yang menyatakan bahwa :
“Jika tekanan gas pada ruang tertutup dijaga konstan, maka volume gas berbanding lurus dengan temperatur.
Bentuk pernyataan dari hukum charles tersebut dapat ditulis dengan persamaan:
V/T = Konstan atau V1/T1 = V2/T2
Keterangan:
V1 = volume gas awal (m3)
V2 = volume gas akhir (m3)
T1 = temperatur mutlak awal (K)
T2 = temperatur mutlak akhir (K)
Berdasarkan persamaan Hukum Charles tersebut hubungan temperatur dan volume dapat digambarkan dalam bentuk grafik berikut
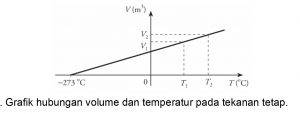
Grafik tersebut berlaku untuk semua jenis gas. Temperatur dinyatakan dalam Kelvin (K). Dasar untuk skala Kelvin ini adalah nol mutlak yaitu suhu terendah yang dicapai gas -273 °C atau 0 K. Sehingga semua jenis gas tidak dapat didinginkan lagi kurang dari nol mutlak.
baca juga:
-
Hukum Gay Lussac
Satu lagi ilmuan yang berpengaruh terhadap persamaan gas ideal yang melakukan pengamatan tentang hubungan tekanan dan temperatur gas pada volume tetap adalah Joseph Gay Lussac. Dan menghasilkan pernyataan atau hukum yang dikenal dengan Hukum Gay Lussac. Pernyataan yaitu sebagai berikut:
“tekanan gas berbanding lurus dengan temperatur gas jika volume pada ruang tertutup adalah tetap”.
Pernyataan tersebut dapat ditulis dengan persamaan berikut:
P/T = Konstan atau P1/T1 = P2/T2
Keterangan :
P1 = tekanan gas awal (N/m2)
P2 = tekanan gas akhir (N/m2)
T1 = temperatur mutlak awal (K)
T2 = temperatur mutlak akhir (K)
Persamaan hubungan antara tekanan dan temperatur pada Hukum Gay Lussac dapat dinyatakan dalam grafik sebagai berikut:
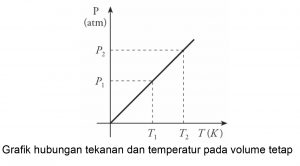
-
Hukum Boyle – Gay Lussac
Hasil dari penggabungan dari ketiga hukum dari ilmuan di atasmaka akan didapat datu persamaan yang kemudian dikenal dengan Hukum Boyle-Gay Lussac. Penggabungan hukum tersebut dapat dinyatakan dengan persamaan sebagai berikut:
P.V / T = konstan Atau P1.V1/T1=P2.V2/T2
Keterangan :
P1 = tekanan gas awal (N/m2)
P2 = tekanan gas akhir (N/m2)
T1 = temperatur mutlak awal (K)
T2 = temperatur mutlak akhir (K)
V1 = volume gas awal (m3)
V2 = volume gas akhir (m3)
Contoh Soal:
Gas ideal bersuhu 47 oC sebanyak 4 liter memiliki tekanan 1 atmosfer. Berpakah tekanan gas ideal tersebut jika suhu nya dinaikan menjadi 57 oC dan volumenya 3,3 liter!
Penyelesaian:
Diketahui:
V1 = 4 liter
V2 = 3,3 liter
P1 = 1 atm
T1 = 47 oC = 47 + 273 = 320 K
T2 = 57 oC = 47 + 273 = 330 K
Ditanyakan : P2………….?
Jawab:
P1.V1/T1 = P2.V2/T2
(1 x 4)/320 = P2 (3,3)/330
0,0125 = P2 (0,01)
P2 = 1,25 atm
Tekanan gas ideal terakhir adalah 1,25 atm
-
Hukum Umum Gas Ideal
Setiap gas memiliki karakteristik yang berbeda-beda jika tekanan, volumedan temperatur pada gas yang berbeda walaupun jumlah molekulnya sama. Oleh karena itu diperlukan konstanta yang kemudian dinamai konstanta Boltzman (k).
Sehingga persamaan dapat dituiskan sebagai berikut:
PV = NkT atau PV = n NA k T
Keterangan:
N = jumlah molekul gas
NA = bilangan Avogadro (6,02 x 1023 molekul/mol)
n = jumlah mol gas
k = konstanta Boltzman (1,38 x 1023J/K)
NA & k disebut dengan konstanta gas umum yang dilambangkan dengan R. Sehingga persamaan dapat dituliskan menjadi :
PV = nRT
Keterangan:
R = konstanta gas umum
= 8,314 J/mol K
= 0,082 L atm/mol K
Persamaan terakhir yang kemudian disebut Persamaan Gas Ideal.
Contoh Soal:
Volume oksigen (O2) 5 liter bertekanan 2 x 105Pa memiliki massa 16 gram. Jika R = 8,31 J/mol.K, berapakah suhu helium tersebut?
Penyelesaian:
Diketahui:
m = 16 gram
Mr O2= Ar O x 2 = 32
P = 2 x 105Pa
R = 8,31 J/mol.K
V = 5 liter = 5 x 10-3 m3
Ditanya: T … ?
Jawab:
n = M/Mr = 16/32
sehingga
P . V = n . R . T
T = P.V/n.R
T = (2 x 105)(5x 10-3)/(0,5)(8,31)
T = 2,406 x 102K
Itulah penjelasan mengenai persamaan gas ideal berikut contohnya. Semoga dapat bermanfaat.

