Penurunan Tekanan Uap – Pengertian, Rumus, dan Contoh Soal
Penurunan Tekanan Uap terjadi karena zat terlarut yang sangat tinggi dan tidak mengalami penguapan. Di artikel yang sebelumnya telah dijelaskan salah satu sifat Koligatif larutan yaitu Kenaikan Titik Didih. Kali ini kita akan mempelajari lebih mendalam tentang sifat yang lain yaitu Penurunan Tekanan Uap. Namun sebelum kita membahas lebih jauh tentang Penurunan Tekanan Uap Larutan alangkah lebih baik jika kita memahami terlebih dahulu tentang proses penguapan.
Penurunan Tekanan Uap
- Pertama sediakan sebuah tempat / gelas yang diisi air. Apa yang terjadi pada volume air jika benda berisi air tersebut dibiarkan ditempat terbuka di siang hari selama beberapa jam? Jawaban nya pasti volume air dalam gelas akan berkurang dikarenakan adanya proses penguapan.
- Karena kondisi gelas dibiarkan tidak tertutup dan berada di ruangan terbuka maka volume air akan mengalami penurunan secara terus menerus. Hal ini akan berbeda jika kita melakukannya pada ruang tertutup.
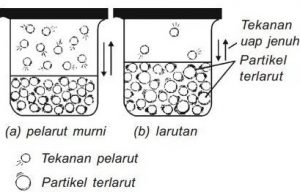
- Sekarang kita isikan air kedalam sebuah wadah tertutup dan dihubungkan dengan pengukur tekanan :
- Pada awal percobaan kita bisa melihat ketinggian dikedua bagian kaki pipa akan sama, hal itu disebabkan molekul air yang ada belum mengalami penguapan. Setelah kita biarkan selama beberapa jam maka terjadi perubahan ketinggian raksa pada pipa U. (Baca Juga : Organ-Organ Pernapasan)
- Terjadinya perubahan ketinggian raksa yang ada pada pipa U tersebut menunjukkan bahwa ada tekanan pada molekul air akibat proses penguapan. Penguapan akan terjadi pada permukaan molekul dan terus – menerus sampai keadaan air dalam posisi setimbang.
- Pada posisi setimbang ini diketahui ternyata jumlah molekul air yang meninggalkan cairan dikarenakan proses penguapan sama dengan jumlah molekul air yang masuk kedalam cairan. Tekanan yang terjadi pada saat suatu liquid berada pada kondisi setimbang dengan uap molekul liquid yang berada diatasnya inilah yang disebut sebagai Tekanan Uap Liquid atau Larutan.
- Maksud dari istilah liquid yang saya pakai diatas adalah mengarah ke zat – zat tertentu seperti air, etanol, bensena, dan senyawa-senyawa lain yang berwujud cair dimana zat ini biasanya sering digunakan sebagai pelarut, maka dari itu istilah “tekanan uap liquid” untuk pembahasan selanjutnya disebut sebagai Tekanan Uap Pelarut.
- Besarnya tekanan uap pelarut yang muncul tidak dipengaruhi oleh banyaknya jumlah pelarut yang dipakai melainkan dipengaruhi oleh suhu. Jadi pada suhu / temperature yang berbeda akan menimbulkan tekanan uap pelarut yang berbeda pula. Misalnya pada suhu kamar (25 derajat celcius) kita peroleh tekanan uap air adalah sebesar 20 mmHg.
- Apa yang akan terjadi jika kita melarutkan zat yang nonvolatile atau zat yang tidak mudah menguap, contohnya seperti zat glukosa ke dalam wadah berisi air dan dihubungkan pada pengukur tekanan? Misalkan pada suhu yang sama ternyata kita memperoleh tekanan uap larutan glukosa sebesar 18,5 mmHg.
- Adanya suatu zat terlarut di dalam suatu pelarut akan menimbulkan penurunan tekanan uap pelarutnya. Kita lihat pada contoh diatas adalah pada suhu 25 derajat celcius diperoleh tekanan uap air murni adalah sebesar 20 mmHg sedangkan pada zat glukosa dalam air pada suhu yang sama tekanan uapnya menurun menjadi 18,5 mmHg. (Baca Juga : Molalitas )
- Perbedaan nilai tekanan uap yang ternyata lebih kecil antara larutan air dan glukosa menandakan bahwa jumlah molekul pelarut yang menguap diatas larutan jumlahnya lebih sedikit jika dibandingkan dengan jumlah molekul yang menguap diatas pelarut murni.
Dari beberapa percobaan yang kita lakukan diatas bisa diketahui bahwa terjadi penurunan tekanan uap pelarut lebih besar jika dibandingkan dengan tekanan uap larutan, oleh karena itulah maka sifat koligatif ini biasa disebut sebagai Penurunan Tekanan Uap Larutan.
Tekanan Uap Pelarut lebih besar dari Tekanan Uap Larutan
Campuran seperti larutan memiliki entropi atau energi yang lebih besar dibandingkan dengan material tunggal atau pelarut murni. Kenaikan entropi ini akan menimbulkan kenaikan energi juga, yang diperlukan untuk memindahkan molekul pelarut dari fasa liquid atau cairan ke fasa gas.
Bagaimana cara kita Menghitung Penurunan Tekanan Uap Larutan? Pertama kita titik berat kan penurunan tekanan uap yang terjadi untuk zat yang dilarutkan pada pelarut yang bersifat non volatile. Non volatile adalah sifat tidak mudah menguap sedangkan volatile adalah sifat mudah menguap.
- Zat terlarut yang berada di dalam suatu pelarut akan menimbulkan penurunan jumlah molekul pelarut untuk setiap unit volumenya, dengan semakin turun nya jumlah molekul pelarut tiap satuan volume yang terdapat di dalam suatu larutan jika kita bandingkan dengan jumlah molekul pelarut yang terdapat dalam suatu pelarut murni akan memperkecil jumlah molekul yang dapat menguap sehingga dengan demikian tekanan uapnya pun akan mengalami penurunan juga. Untuk mempermudah pengertian jika volume besar maka luas permukaan besar, sedangkan apabila volume kecil maka luas permukaan kecil sehingga menimbulkan perbedaan jumlah molekul H2O yang mengalami proses penguapan.
- Dalam bentuk energi, adanya zat terlarut dalam suatu zat pelarut akan meningkatkan ketidakteraraturan di dalam zat. (Baca Juga : Contoh Elektrolit Lemah)
Hubungan antara tekanan uap jenuh larutan dengan tekanan uap pelarutnya pernah dijabarkan oleh Francios M. Raoult dimana dia memperkenalkan rumus sebagai berikut:

Dengan Keterangan :
P = Tekanan uap jenuh larutan
Po = Tekanan uap pelarut murni
Xp = Fraksi mol pelarut
Penurunan tekanan dari P0 ke P disebut penurunan tekanan uap, yang disimbolkan dengan ΔP, yang mana ΔP dirumuskan dengan :
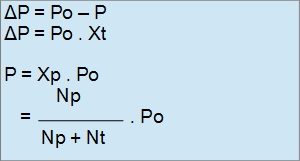
Dengan Keterangan :
ΔP : Penurunan Tekanan Uap
P : Tekanan Uap Jenuh Larutan
Po : Tekanan Uap Pelarut Murni
Xp : Fraksi Mol Pelarut
np : Mol Pelarut
nt : Mol Zat Terlarut
Faraksi mol (X) dalam hal ini dinyatakan sebagai bentuk perbandingan antara mol suatu spesies dengan mol total dimana spesies itu berada. Jadi jika dicontohkan suatu larutan dibuat dari pelarut air dan zat terlarut berupa urea. Maka fraksi mol pada masing – masing zat adalah sebagai berikut:
X air = mol air / mol air + mol urea dan
X urea = mol urea / mol air + mol urea
Jumlah fraksi mol untuk setiap penyusun campuran apabila dijumlahkan akan kita peroleh nilai = 1, untuk fraksi mol larutan urea diatas maka dapat dinyatakan :
X air + X urea = 1
Apabila larutan hanya diperoleh dari dua komponen yaitu pelarut (p) dan suatu zat terlarut (t) maka hubungan fraksi mol keduanya dapat dinyatakan sebagai berikut :

Jika persamaan 1 dan 2 digabungkan maka akan diperoleh persamaan sebagai berikut:
P= Xp . Po
Dengan Xp = 1 – Xt maka diperoleh,
P = (1 – Xt) Po
P = Po – Xt . Po
P – Po = Xt . Po
P = Xt . Po…….( persamaan 3 )
Persamaan 3 inilah yang dapat kita pakai untuk mengetahui berapa besarnya penurunan uap suatu larutan. Untuk mencari penurunan tekanan uap kita bisa melihat melalui persamaan 1 atau pun 3. Yang perlu kita ingat adalah jika kita menggunakan rumus 1 maka fraksi mol yang dipakai adalah Xp (fraksi mol pelarut) namun jika menggunakan rumus 3 maka fraksi mol yang dipakai adalah Xt (fraksi mol zat terlarut). Itulah perbedaan mendasar dari kedua persamaan diatas. (Baca Juga : Perbedaan Larutan Elektrolit dan Non Elektrolit)
Bagaimana jika zat terlarut di dalam suatu pelarut bersifat volatile?
Penjelasan diatas lebih kita utamakan kepada suatu larutan yang sifat zat terlarutnya adalah nonvolatile, sedangkan untuk larutan yang dibangun dari zat terlarut yang bersifat volatile?
Contoh campuran ini adalah bensena – toluena, air – etanol, atau aseton – etil asetat. Karena dengan zat terlarut yang bersifat volatile maka uap zat terlarut ini akan bereaksi terhadap total uap larutan. Uap yang ada didalam larutan jenis ini didapatkan dari molekul zat terlarut dan molekul pelarut.
Setelah membaca penjelasan diatas maka total tekanan uap larutan dapat dinyatakan dengan rumus:

Perlu kita ingat bahwa Hukum Raoult hanya berlaku untuk larutan yang bersifat ideal atau larutan dengan konsentrasi rendah. Dimana larutan ideal dicapai jika interaksi antara solute – solut, solvent – solvent, solute – solvent diperoleh nilai yang hampir sama. Campuran yang memenuhi Hukum Raoult atau bersifat ideal contohnya adalah bensena – toluena. Pencampuran keduanya akan menghasilkan entalpi yang hampir bernilai nol “0” sehingga campuran ini bersifat “ideal”.
Apabila ketika pelarutan zat terlarut ke dalam suatu pelarut dibebaskan panas (eksoterm) maka entalpinya akan bernilai negative, kita dapat mengasumsikan bahwa terjadi suatu interaksi yang kuat antara zat pelarut dan zat terlarut, hal ini bisa menyebabkan pelarut memiliki tendensi yang lebih kecil untuk menguap dan nilai tekanan uap larutannya akan jauh lebih kecil dibandingkan dengan nilai yang ditentukan dari hukum Raoult itu sendiri, kejadian ini disebut sebagai “deviasi negative hukum Raoult”. Contohnya yaitu melarutkan zat aseton dengan air atau campuran antara kloroform dengan zat aseton. Interaksi kuat antara aseton – air atau aseto – klorofom diakibatkan oleh adanya ikatan hidrogen diantara keduanya.
Contoh Soal Penurunan Tekanan Uap Larutan
1. Tekanan uap air pada suhu 25 0C adalah 23,76 mmHg. Jika pada suhu yang sama, kedalam 900 mL air ditambahkan urea (Mr = 60 g/mol), tekanan uap larutan menjadi 22,84 mmHg. Penurunan tekanan uap larutan tersebut adalah…
Diketahui:
T = 25 0C
P0 = 23,76 mmHg.
V = 900 mL
Mr = 60 g/mol.
P = 22,84 mmHg.
Ditanya: ΔP = …
Jawab:
ΔP = P0 – P = 23,76 mmHg – 22,84 mmHg = 0,92 mmHg
2. Tekanan uap air pada suhu 25 0C adalah 23,76 mmHg. Jika pada suhu yang sama, kedalam 900 mL air ditambahkan urea (Mr = 60 g/mol), tekanan uap larutan menjadi 22,84 mmHg. Fraksi mol larutan tersebut adalah….
Pembahasan
Diketahui:
T = 25 0C
P0 = 23,76 mmHg.
V = 900 mL
Mr = 60 g/mol.
P = 22,84 mmHg.
Ditanya: xp = …
Jawab:
xp = ΔP / P0 = 0,92 mmHg / 23,76 mmHg
xp = 0,0387
3. Fraksi mol urea dalam air adalah 0,5. Tekanan uap air pada 20°C adalah 17,5 mmHg. Berapakah tekanan uap jenuh larutan tersebut pada suhu tersebut?
Penyelesaian:
Diketahui :
xA = 0,5
P0 = 17,5 mmHg
Ditanya : P …?
Jawab : ΔP = xA ⋅ P0
= 0,5 ⋅ 17,5 mmHg
= 8,75 mmHg
P = P0 – ΔP
= 17,5 mmHg – 8,75 mmHg
= 8,75 mmHg
Jadi begitulah penjelasan tentang Penurunan tekanan uap. Contoh penurunan tekanan uap di kehidupan sehari hari adalah pada kolam renang apung ditempat wisata yang mengadopsi ciri khas dari laut mati yang apabila anda berenang anda tidak akan tenggelam. Hal ini dikarenakan di laut mati zat terlarut yang sangat tinggi. Semoga bermanfaat untuk anda.