Kenaikan Titik Didih Larutan – Pengertian dan Rumus
Kenaikan Titik didih ( Tb ) merupakan suhu yang terbentuk ketika besar tekanan uap sebuah zat cair sama dengan besar tekanan eksternal yang dialami oleh cairan tersebut, atau mudahnya titik didih ini juga dapat disebut sebagai kondisi ketika sebuah zat pelarut atau sebuah larutan berada pada kondisi mendidih yang menyebabkan terjadinya penguapan pada seluruh bagian zat pelarut atau larutan tersebut. Cara untuk mendapatkan tekanan uap yang sama dengan tekanan eksternalnya adalah dengan memberikan energi ( kalori ) pada zat tersebut.
Kenaikan Titik Didih
Titik didih sebuah cairan sangat dipengaruhi oleh besarnya tekanan lingkungan sekitar. Semakin tinggi tekanan lingkungan sekitar maka akan semakin tinggi pula titik didihnya, begitu pula sebaliknya. Sedangkan jika berada pada tekanan yang sama namun cairannya berbeda akan terlihat pada perbedaan suhu saat mencapai titik didih. Contoh nyatanya dapat kita perhatikan ketika merebus telur di pegunungan dan di pantai. Jika diperhatikan secara seksama, telur akan lebih cepat matang ketika direbus di daerah pantai daripada di daerah pegunungan. Ini terjadi karena tekanan udara di pegunungan lebih kecil daripada tekanan udara di pantai. Semakin tinggi lokasi suatu daerah, maka semakin rendah tekanan udara di daerah tersebut. Seperti yang telah dijelaskan, semakin tinggi tekanan artinya semakin tinggi pula titik didihnya, begitu pula sebaliknya. Lebih tingginya titik didih di pantai inilah yang berpengaruh pada kecepatan merebus telur.
Ketika sebuah zat pelarut seperti air murni dicampurkan dengan zat terlarut seperti gula, garam atau zat terlarut lainnya yang kemudian menjadi larutan maka titik didih larutan tersebut akan berbeda dengan titik didih ketika hanya terdapat zat pelarut saja ( seperti air murni ). Suhu ketika zat pelarut mencapai titik didih dinamakan titik didih pelarut sedangkan pada larutan disebut titik didih larutan. Titik didih larutan dapat lebih tinggi atau juga dapat lebih rendah daripada titik didih pelarut. Ini tergantung pada kemampuan zat terlarut yang dicampurkan pada pelarut dalam mencapai titik didih. Selisih antara titik didih larutan dengan titik didih pelarut inilah yang disebut dengan kenaikan titik didih ( ∆Tb ).
Rumus untuk menentukan kenaikan titik didih ( ∆Tb ) adalah:

Untuk larutan yang bersifat elektrolit, maka persamaannya akan berubah menjadi:
Tb = Kb . m [ 1 + ( n – 1 ) α ]
Keterangan:
∆Tb = Kenaikan titik didih larutan
Kb = Tetapan kenaikan titik didih molal pelarut ( kenaikan titik didih untuk 1 mol zat untuk setiap 1000 gram pelarut )
m = Molal larutan ( mol per 100 gram pelarut )
n = Jumlah ion dalam larutan yang dihasilkan dari setiap satuan rumus kimia seyawa terlarut
α = Derajat ionisasi ( untuk larutan elektrolit kuat secara umum nilainya dianggap = 1 )
Baca Juga: Perbedaan Larutan Elektrolit dan Non Elektrolit
Faktor-faktor Yang Mempengaruhi Titik Didih
- Konsentrasi ( molal ) zat terlarut mempengaruhi kenaikan titik didih, dimana semakin besar konsentrasi ( molal ) dari zat terlarut maka kenaikan titik didih juga akan semakin besar.
- Konsentrasi ( molalitas ) dan harga Kb sangat berpengaruh pada kenaikan titik didih.
- Semakin tinggi konsentrasi ( molalitas ), semakin tinggi pula kenaikan titik didihnya.
- Semakin tinggi harga Kb, semakin tinggi pula kenaikan titik didihnya. Harga Kb diperoleh dengan melakukan pengukuran kenaikan titik didih dari larutan encer yang telah diketahui nilai molalitasnya ( mengandung zat terlarut yang diketahui jumlah dan massa molalnya ).
- Dalam konsentrasi yang sama, jenis zat yang terlarut mempengaruhi kenaikan titik didih suatu larutan, dimana larutan elektrolit memiliki kenaikan titik didih yang lebih tinggi daripada kenaikan titik didih pada larutan non elektrolit. Hal ini disebabkan karena partikel-partikel terlarut yang terdapat pada larutan elektrolit lebih besar daripada larutan non elektrolit.
- Semakin banyak zat terlarut yang dicampurkan maka semakin besar pula suhu yang diperlukan untuk mencapai titik didih.
- Tidak tergantung pada macamnya zat terlarut.
Hukum Roult
Menurut hukum Roult disebutkan bahwa tekanan parsial dari uap komponen yang mudah menguan pada sebuah larutan sama dengan tekanan uap murni dikali dengan fraksi molalnya. Dengan adanya zat terlarut pada sebuah larutan maka tekanan uap zat pelarut akan berkurang dan disinilah terjadi kenaikan titik didih, penurunan titik beku dan tekanan uap osmosis.
Keempat sifat tersebut ( dapat disebut juga sifat koligatif larutan ) tidak dapat ditentukan hanya dari jenis zat terlarut namun hanya dapat ditentukan oleh banyaknya zat terlarut. Perbedaan titik didih dapat terjadi ketika terdapat zat terlarut ( solute ) yang sukar menguap ( non volatile ) pada sebuah larutan sehingga tekanan uap menurun dan menyebabkan titik didih larutan menjadi lebih tinggi daripada titik didih pelarutnya.
Setiap zat cair memiliki tekanan uap jenuh tertentu pada suhu tertentu serta memiliki harga yang tetap. Zat cair akan mencapai titik didih dalam keadaan terbuka hanya jika tekanan uap jenuhnya sama dengan tekanan atmosfer. Umumnya adalah ketika zat cair berada pada saat tekanan udaranya 1 atm, zat cair akan mendidih pada suhu 100°C. Namun ketika zat tersebut dicampurkan dengan zat terlarut, maka tekanan uap jenuh pada zat tersebut akan berkurang. Penurunan tekananan uap jenuh yang terjadi ketika zat pelarut dicampurkan dengan zat terlarut ( telah menjadi larutan ) yang lebih rendah jika dibandingkan dengan tekanan uap jenuh zat pelarut saja inilah yang menyebabkan titik didih larutan lebih tinggi daripada titik didih pelarut.
Perubahan titik didih yang terjadi antara zat pelarut dengan larutan dapat digambarkan dengan persamaan berikut:
![]()
Karena adanya kondisi bahwa tekanan uap larutan yang lebih rendah jika dibandingkan dengan tekanan uap zat pelarut menyebabkan adanya penurunan titik beku larutan lebih rendah daripada penurunan titik beku zat pelarut. Selisih yang terjadi antara temperatur titik beku larutan dengan temperatur titik beku pelarut dapat disebut dengan penurunan titik beku ( ∆Tf ) yang dapat digambarkan dengan persamaan berikut:
∆Tf = Tf ( pelarut ) – Tf ( larutan )
Menurut Hukum Backman dan Raoult, penurunan titik beku dan kenaikan titik didih berbanding langsung dengan molalitas yang terlarut didalamnya, dan hukum ini dapat dirumuskan sebagai berikut:
∆Tb = m . Kb
∆Tf = m . Kf
Keterangan:
∆Tb = Kenaikan titik didih
Kb = Tetapan kenaikan titik didih molal
∆Tf = Penurunan titik beku
Kf = Tetapan titik beku molal
m = Molalitas
Syarat pada hukum Backman dan Roult adalah sebagai berikut:
- Rumus yang telah dituliskan diatas ( ∆Tb dan ∆Tf ) hanya berlaku pada larutan yang bersifat non elektronik.
- ∆Tb tidak berlaku pada larutan yang dapat dengan mudah menguap.
- Hukum ini akan menyimpang jika digunakan pada larutan yang pekat, sehingga hukum ini hanya berlaku pada larutan yang encer.
Tekanan Osmosis
Osmosis adalah proses perpindahan molekul zat pelarut dari semipermiabel selektif dari bagian yange encer ke bagian yang lebih pekat. Membran semipermiabel ini harus dapat ditembus oleh zat pelarut, namun juga harus tidak dapat ditembus oleh zat terlarut sehingga menyebabkan adanya gradien tekanan sepanjang membran. Atau dalam kata lain, Osmosis ini hanya terjadi dari larutan yang memiliki konsentrasi kecil menuju larutan yang memiliki konsentrasi besar. Atau juga dapat disebut sebagai peristiwa mengalirnya molekul-molekul zat pelarut dari yang lebih encer menuju zat pelarut yang lebih pekat.
Tekanan Osmosis atau juga biasa disebut Osmosa merupakan tekanan yang diperlukan dalam menghentikan aliran yang terjadi pada zat pelarut ke dalam larutan. Van’t Hoff menyatakan bahwa besarnya tekanan Osmosis sebuah larutan dapat dinyatakan dengan rumus berikut:

Keterangan:
∏ = Tekanan Osmosis larutan
M = Molaritas larutan ( mol / L )
R = Konstanta, gas = 0,08205 L atm mol-1 K-1
T = Suhu mutlak ( °C + 273 ) K
Contoh kenaikan titik didih pada kehidupan sehari-hari
1. Radiator kendaraan bermotor
Radiator yang biasa digunakan pada kendaraan bermotor memerlukan kemampuan yang bagus dalam mengendalikan panas yang dihasilkan ketika kendaraan digunakan dalam waktu yang cukup lama. Dari sinilah perhitungan akan kenaikan titik didih sangat diperlukan, karena cairan pada sebuah radiator harus memiliki titik didih yang tinggi untuk mendinginkan mesin tanpa harus kehilangan banyak cairan itu sendiri. Jika titik didihnya rendah, maka cairan pada radiator akan lebih cepat menguap yang akhirnya menyebabkan radiator kehabisan cairan.
2. Memasak air
Ini adalah hal yang sangat sering dilakukan sehari-hari oleh siapapun. Secara awam, ini dilakukan karena saat air mendidih artinya air sudah matang. Selain itu, dengan memasak air hingga mendidih juga mampu menghilangkan zat-zat berbahaya yang bisa saja terdapat pada air tersebut. Ditambah lagi, dengan memasak air juga mampu mengendapkan phosfor atau kapur.
3. Menambahkan bumbu saat air mendidih
Tanpa disadari ketika kita menambahkan bumbu saat air mendidih telah terjadi kenaikan titik didih. Dapat kita perhatikan dari kondisi mendidihnya. Ketika masih berupa air saja, terlihat air sudah mendidih. Namun ketika ditambahkan bumbu atau bahan terlarut lainnya, air akan perlahan menurunkan tekanan uapnya, sehingga terlihat tingkat mendidih air saat sebelum ditambahkan bumbu atau bahan terlarut lainnya dengan ketika telah ditambahkan terlihat cukup berbeda.
4. Panci presto ( panci yang tertutup )
Menggunakan panci presto ( panci yang tertutup ) akan sangat berpengaruh pada tingkat kematangan makanan. Panci dalam kedaan tertutup dapat meningkatkan tekanan air dalam panci, serta temperatur rebusan pun menjadi lebih dari 100°C. Dan hal ini dapat membuat makanan yang dimasukkan ke dalam panci presto akan lebih empuk serta tulang-tulang yang awalnya keras pun menjadi lunak.
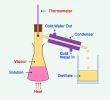
5. Distilasi atau penyulingan
Distilasi adalah suatu metode yang memisahkan materi kimia berdasarkan kemampuan menguap ( volatilitas ) suatu zat. Contoh penerapan distilasi dapat dilihat pada proses penyulingan minyak kayu putih dari daunnya, atau juga dapat dilihat pada penyulingan minyak bumi.
Dengan adanya teori kenaikan didih ini, kita akan sangat terbantu ketika menentukan tingkat mendidih yang dibutuhkan oleh suatu benda atau alat, terutama bagi kita yang berkecimpung di dunia otomotif diharuskan mampu memperhitungkan segala kemungkinan agar mesin dapat berjalan dengan lancar dan tahan lama.